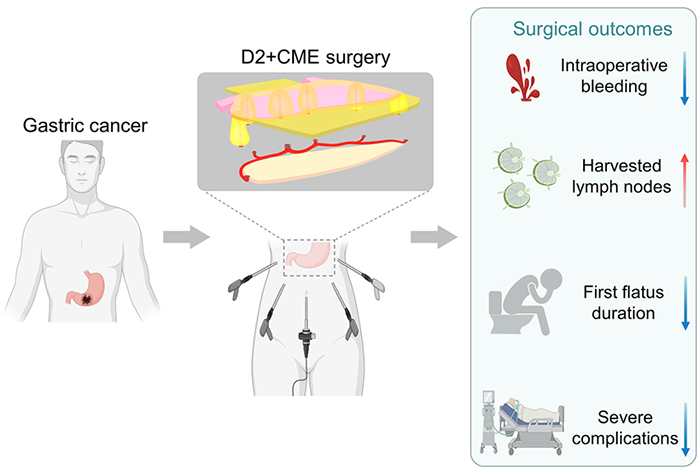
3月16日,华中科技大学同济医学院附属同济医院龚建平教授团队在Cell Press细胞出版社期刊Cell Reports Medicine上发表了一篇最新研究,题为“Complete mesogastric excision for locally advanced gastric cancer: short-term outcomes of a randomized clinical trial”。课题组建立了“D2清扫+胃完整系膜切除术(D2 lymphadenectomy plus complete mesogastric excision, D2+CME)”,并证明相比传统D2根治术,D2+CME可以减少胃癌细胞从系膜内“泄漏”至腹腔内手术野,具有更好的近期疗效及手术安全性。
胃癌是全球主要恶性肿瘤之一,每年新发病例约100万,死亡率高居第二位[1]。在我国,绝大多数为进展期胃癌[2]。外科手术是治疗胃癌的首选方案[3]。针对进展期胃癌,目前标准的手术方式是D2根治术,即胃切除加上D2淋巴结清扫[4],然而,治疗效果并不理想,术后仍有高达38%-50%的患者复发[5, 6]。
“en bloc”(整块)切除,一直是肿瘤外科医生百余年来的念想,面对几近“完成”的解剖学,“en bloc”的边界,却无从界定。在过去的三十多年,“全直肠系膜切除”(Total Mesorectal Excision, TME)和“完整结肠系膜切除”(Complete Mesocolic Excision, CME)在结直肠肿瘤手术中展现出优异的肿瘤学疗效,极大降低了术后复发,提高了患者生存率[7, 8]。问题是这种系膜切除的肿瘤学疗效,仅仅是因为淋巴清扫更彻底吗?仅仅存在于结直肠吗?系膜切除在胃癌手术中的治疗效果并不清楚。
在我们的前期研究中,我们论证了胃背侧系膜近侧段(proximal segment of dorsal mesogastrium, PSDM)的解剖学结构[9];报道了在其内部检测到散在的孤立癌结节,提出PSDM内不仅仅有淋巴转移,还可能存在“第五转移”潜行[10, 11]。为了实现PSDM的“en bloc”切除,我们建立了“D2清扫+胃完整系膜切除术(D2 lymphadenectomy plus complete mesogastric excision, D2+CME)”,通过回顾性研究初步评估了D2+CME的安全性及有效性[12]。接着,我们证明,相比传统D2根治术,D2+CME可以减少胃癌细胞从系膜内“泄漏”至腹腔内手术野[13]。从而,形成了进一步的预言:沿着PSDM的解剖进行手术,在D2范围内进行CME(即D2+CME),可以获得更优的外科学与肿瘤学疗效。
为了检验这一预言,我们设计了这项单中心临床随机对照试验,旨在比较D2+CME与传统D2手术治疗进展期胃癌的疗效。在为期4年的入组过程中,我们共筛选了2588例胃癌患者。依据纳入与排除标准,最终有338例胃癌患者入组(D2组:169人;D2+CME组:169人),收集资料并整理分析。
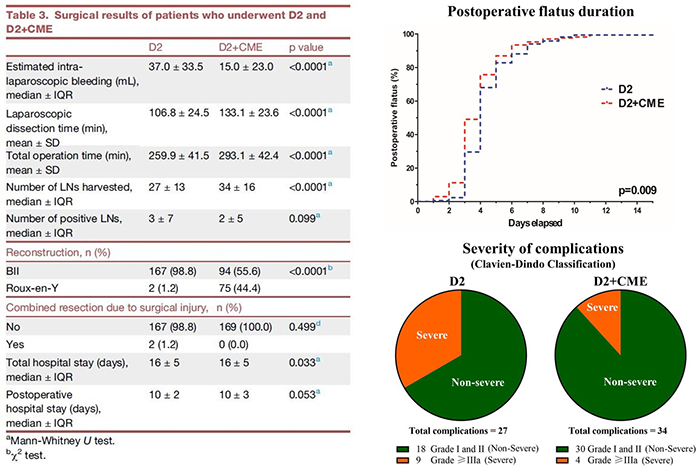
外科学资料表明,相比传统D2手术而言,D2+CME术中出血量更少(D2+CME组:15.0ml±23.0ml;D2组:37.0ml±33.5ml;p<0.0001),淋巴结收获数更多(D2+CME组:34±16枚;D2组:27±13枚;p<0.001),术后肠道通气时间更短(Log-rank检验,p=0.009)。Clavien-Dingo术后并发症资料分析,D2+CME可以显著降低严重并发症的发生率(Grade IIIa及以上:D2+CME组:4例;D2组:9例;p=0.041)。 因此,本研究证明,对于进展期胃癌患者,D2+CME具备更好的近期疗效及手术安全性。 基于对PSDM的认识,D2+CME不仅改善了胃癌的外科学疗效,也开启肠外系膜的寻找与利用,并由此引导出“膜解剖”理论——广义的系膜与系膜床的解剖,为沉寂多年的肿瘤外科领域,带来了新的曙光[14]。相对传统的器官解剖、血管解剖而言,外科医生依照“膜解剖”进行手术,犹如有了3.0版的解剖地图,精准且不断再现。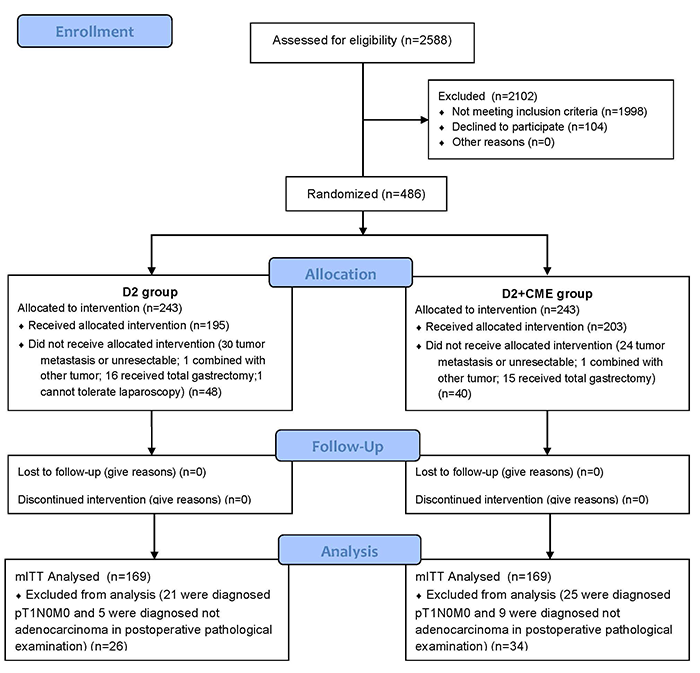
参考文献
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin 2015; 65: 87–108.
2. 詹友庆, 孙献甫, 张华政,等. 胃癌外科治疗的远期疗效研究. 中华外科杂志, 2005, 43(017):1109-1113.
3. Sasako M, Saka M, Fukagawa T, Katai H, Sano T. Surgical treatment of advanced gastric cancer: Japanese perspective. Dig Surg 2007; 24: 101–107.
4. Japanese Gastric Cancer Association: Japanese gastric cancer treatment guidelines 2010 (ver.3). Gastric Cancer. 2011; 14:113-123.
5. Sasako M, Sano T, Yamamoto S, Kurokawa Y, Nashimoto A, Kurita A et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N Engl J Med 2008; 359: 453–462.
6. Yang SH, Zhang YC, Yang KH, et al. An evidence-based medicine review of lymphadenectomy extent for gastric cancer. Am J Surg. 2009;197:246-251.
7. Heald RJ. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986;1:1479-1482.
8. Hohenberger W, Weber K, Matzel K, et al. Standardized surgery for colonic cancer: complete mesocolic excision and central ligation - technical notes and outcome. Colorectal Dis. 2009 May;11(4):354-64; discussion 364-365.
9. Xie D, Gao C, Lu A, et al. Proximal segmentation of the dorsal mesogastrium reveals new anatomical implications for laparoscopic surgery. Sci Rep. 2015 Nov 6; 5: 16287.
10. Xie D, Osaiweran H, Liu L, et al. Mesogastrium: a fifth route of metastasis in gastric cancer? Med Hypotheses. 2013 Apr; 80(4): 498-500.
11. Xie D, Liu L, Osaiweran H, et al. Detection and Characterization of Metastatic Cancer Cells in the Mesogastrium of Gastric Cancer Patients. PLoS One. 2015 Nov 13;10( 11):e0142970.
12. Xie D, Yu C, Liu L, et al. Short-term outcomes of laparoscopic D2 lymphadenectomy with complete mesogastrium excision for advanced gastric cancer. Surg Endosc. 2016 Nov;30(11):5138-5139.
13. Xie D, Wang Y, Shen J, et al. Detection of carcinoembryonic antigen in peritoneal fluid of patients undergoing laparoscopic distal gastrectomy with complete mesogastric excision. Br J Surg. 2018 Oct;105(11):1471-1479.
14. 龚建平.从胃癌根治术角度浅谈胃背侧系膜近侧段的结构与功能.中华外科杂志, 2020,58(11):822-825.













